
光解水制氢
光解水制氢
转载自中国科学院清洁能源前沿研究重点实验室太阳能材料与器件研究组 仅供学习参考
在当前能源与环境问题日益突出的大背景下,寻找清洁可持续的新能源替代传统化石能源正受到人们越来越多的关注。这其中,氢能以其完全清洁燃烧的优势占据着重要地位。传统的工业制氢主要是通过甲烷重整制得:
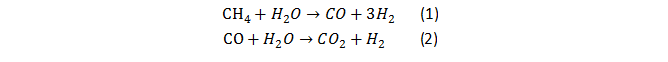
既消耗化石能源,同时又排放了CO2温室气体,给能源和环境问题带来压力。1972年,日本科学家A.Fujishima和K.Honda首次采用光电化学法利用TiO2吸收太阳能把水分解为氢气和氧气(图1),提出了光分解水制氢的概念,从此吸引了众多研究者开展广泛而深入的研究。
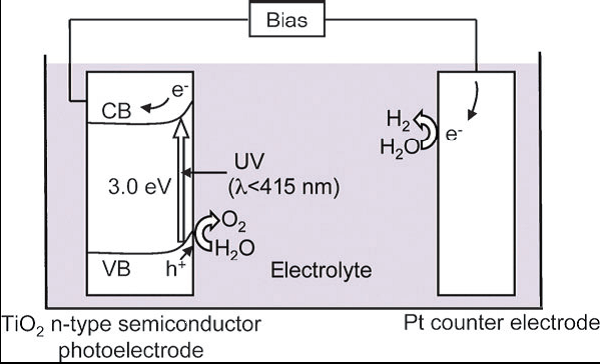
图1.Fujishima-Honda效应
光分解水制氢的原理
光分解水制氢在热力学上是Gibbs自由能增大的过程:![]()
因此又被称为人工光合作用。
光分解水制氢的本质是半导体材料的光电效应。当入射光的能量大于等于半导体的能带时,光能被吸收,价带电子跃迁到导带,产生光生电子和空穴。电子和空穴迁移到材料表面,与水发生氧化还原反应,产生氧气和氢气(图2)。
 |
 |
| 图2.光分解水制氢原理示意图[1] | 图3.光分解水制氢的主要过程示意图[2] |
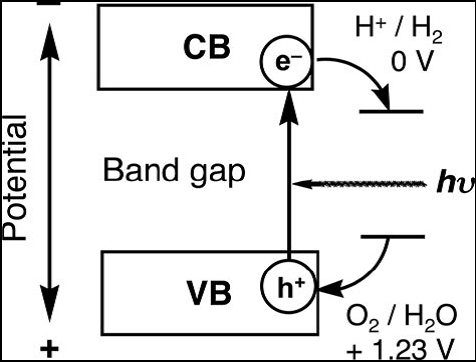
光分解水制氢主要包括3个过程(图3),即光吸收、光生电荷迁移和表面氧化还原反应。
(i) 光吸收。对太阳光谱的吸收范围取决于半导体材料的能带大小: Band gap(eV)=1240/λ(nm),即带隙越小吸收范围越宽。对于光催化制氢催化材料来说,还要求导带的位置高于H+/H2(0V vs. NHE),价带位置低于O2/H2O(1.23 V vs. NHE),因此理论上要求能带大小不小于1.23 eV。
(ii) 光生电荷迁移。材料的晶体结构、结晶度、颗粒大小等因素对光生电荷的分离和迁移有重要影响。缺陷会成为光生电荷的捕获和复合中心,因此结晶度越好,缺陷越少,催化活性越高。颗粒越小,光生电荷的迁移路径越短,复合几率越小。
(iii) 表面氧化还原反应。表面反应活性位点和比表面积的大小对这一过程有重要影响。通常会选用Pt、Au等贵金属纳米粒子或NiO和RuO2等氧化物纳米粒子负载在催化剂表面作为表面反应活性位点,只要负载少量此类助催化材料就能大大提高催化剂的制氢效率。
光催化制氢效率表征的两种方式
目前研究光催化剂的制氢效率主要通过两种方式表征,及光催化分解水(photocatalytic water splitting) 和光电化学分解水(photoelectrochemical water splitting)。
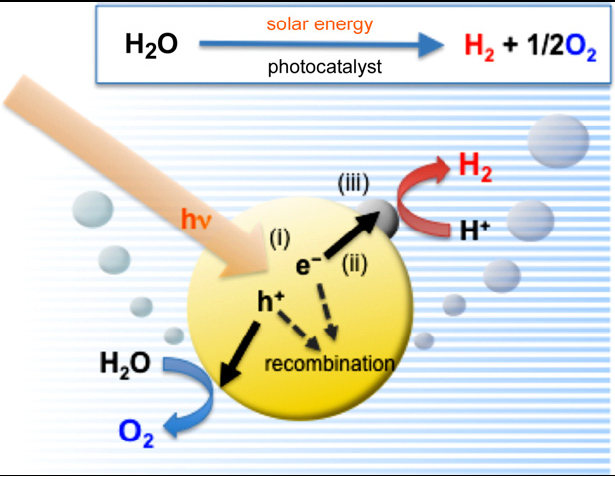
光催化分解水是将粉体催化剂分散在水中(图4)。这种方法的优点是可以大规模应用,但是有氢气和氧气难以分离的问题。为此又发明了两步法(图5),即采用两种催化剂,分别产生氢气和氧气,并通过一种氧化还原电对将这两种催化剂联系起来。这种方法不仅避免了氢气和氧气的分离问题,而且降低了催化剂能带位置的要求,催化剂的选择面更宽,但是也带来了与氧化还原电对的逆反应问题。一步法将水直接分解为氢气和氧气对催化剂的要求较高,因此往往加入牺牲剂来获得氢气或氧气。牺牲剂的作用是消耗光生空穴或电子,比如甲醇、乙醇、乙二醇、乳酸等是常用的制氢牺牲剂,而AgNO3是常用的制氧牺牲剂。
![photocatalysis4 图4.粉体催化剂光分解水制氢示意图[1]](/uploads/allimg/150924/2124263644-5.png) |
 |
| 图4.粉体催化剂光分解水制氢示意图[1] | 图5.两步法分解水示意图[2] |
光电化学分解水是将催化剂制成电,与对电通过导线相连,通常还会加一个偏压(图6)。若半导体材料为n型,则在催化剂电处产生氧气,对电处产生氢气;若半导体材料为p型,则相反。
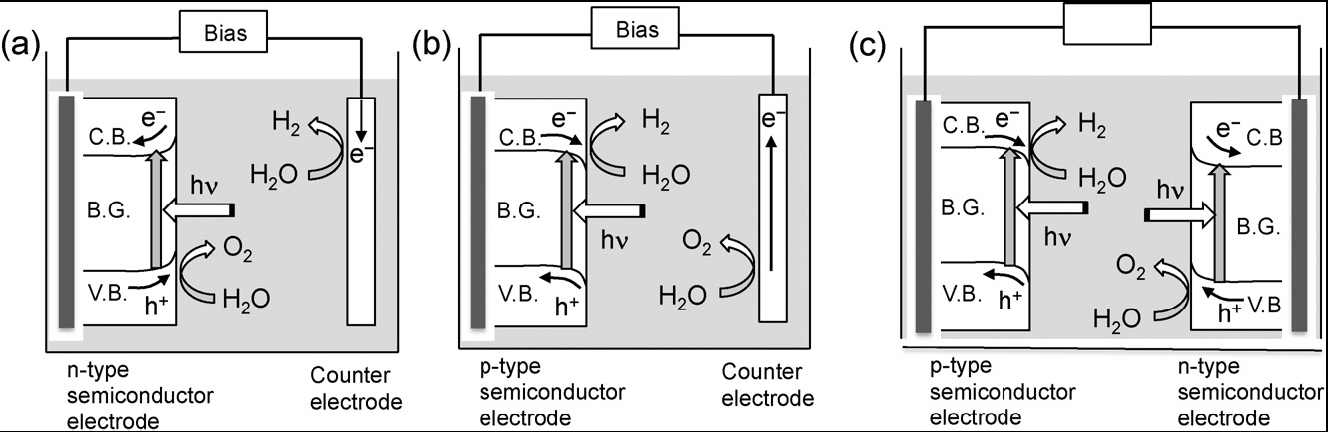
图6. 光电化学分解水系统示意图
光催化分解水装置
粉体催化剂分散在水溶液中制氢,需通过收集反应产生的气体量来评价催化剂的催化性能。目前常用的装置如图7所示,包括反应器、气体取样部、气密循环系统以及抽真空装置,气体取样部与气象色谱相连,可以实时在线检测气体的产生量。光源为高压汞灯(紫外光为主)或氙灯(可见光为主),通过附加滤光片或滤光溶液得到所需波段的光源。由于气体的特殊性,因此对装置的气密性要求较高,操作过程中通过转动特殊设计的阀门来控制。我们组在装置上不断创新改进,目前使用的第三代装置结构更加紧凑,操作更加方便,为开展研究创造了非常好的条件。
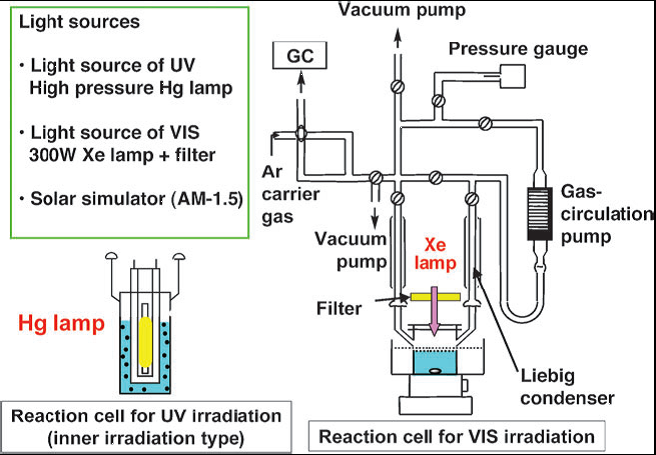
图7. 光催化分解水实验装置示意图[1]
上一篇:光合成制氢
下一篇:UVC汞灯 杀菌
友情链接:
地址:北京市海淀区清河安宁庄东路18号光华创业园7号楼 Copyright © 2011-2020 版权所有 北京纽比特科技有限公司
京ICP备11030022号-1
